
在A-Level考试中,A-Level化学是常考科目之一,有很多关于化学元素方面的知识点,今天,锦秋张翰林将为大家带来离子键的性质,我们来一起看看。
离子键包含着阳离子(cation)和阴离子(anion),通过这两种离子的结合,我们就能得到一个新的化合物,这个化合物就被称为:离子化合物(Ionic compounds)。
结合一张图,我们来看一下这个过程是怎么形成的:
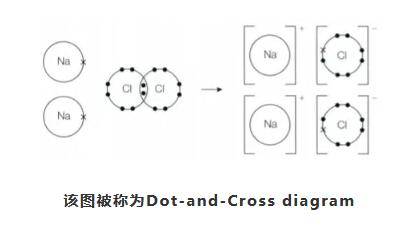
通过“×”和“·”来表达不同元素的最外层电子数以及它们反应前后的位置。那么,钠(Na)在过程中失去了一个最外层电子,而与此同时氯(Cl)获得了一个最外层电子。钠(Na)变成阳离子,氯(Cl)变成了阴离子,通过这个得失电子的过程,钠(Na)和氯(Cl)形成了新的离子化合物:氯化钠(NaCl)。
下面,我们来看一道例题加以说明:
Here is the equation for the formation of mangesium xoide:
2Mg(s)+O₂(g)→2MgO(s)
Draw a dot-and-cross diagram for the reaction.
那么这道题的正确解法如下
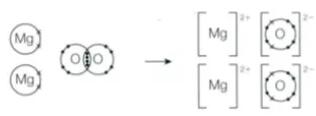
在解题过程中要注意几点。
1. Dot(点)and Cross(叉)要对应不同元素的最外层电子。
2. 生成的离子化合物中,每个元素要用中括号进行区分,同时右上角需要标上相对应的化合价。
仔细观察题中的方程式配平过后需要多少个反应物,产生了多少的生成物。答案中所画的元素数量和配平系数有关。
同学们还记得我们上次提到的离子化合物是巨型层级结构(Giant lattice)吗?这里带大家看一张结构图。
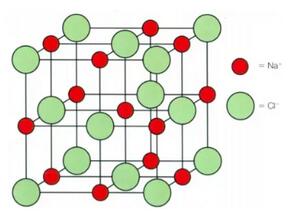
在图上我们可以清楚的看到,Na离子和Cl离子是非常的规律的排布的,而且他们形成了一层一层的结构,又因为离子化合物中拥有大量的层级结构。这才是它被称之为“Giant(因为大量)Lattice(因为层级)”的原因。
现在我们了解了什么是离子化合物,但是在肉眼观察不到的情况下,离子真的存在吗?那就用一个实验来观察一下离子是否存在。
首先我们需要明确,阳离子带正电荷(positive charge),阴离子带负电荷(negative charge)。这就代表了,这两种离子拥有电荷的一个基础特点:同性相斥,异性相吸。
其次,在上次讲堂中提到过,离子化合物固态不导电,但是溶解或者融化变成液态以后就可以导电。这意味着,对液态的离子化合物通电,也许可以通过电荷的特点将不同的离子分开。
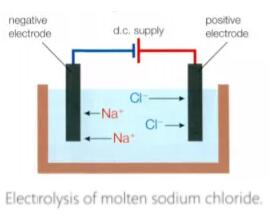
图中的试验,就被我们称之为电解(electrolysis)。在熔融状态下钠离子向负极靠拢得到电子生成金属钠,氯离子向正极靠拢失去电子生成氯气。
更多有关A-Level科目及考试等方面的信息,大家可以扫码关注锦秋A-Level进行了解,锦秋A-Level紧抓中国学生理科优势,进行课程组合化。开设数学、物理、化学、生物、经济学、会计学等课程,帮助学生以优异成绩申请更好的大学。

| 大学名称 | QS排名 |
|---|---|
| 麻省理工学院 | 1 |
| 剑桥大学 | 3 |
| 斯坦福大学 | 3 |
| 牛津大学 | 2 |
| 哈佛大学 | 5 |
| 加州理工学院 | 6 |
| 帝国理工学院 | 7 |
| 伦敦大学学院 | 8 |
| 苏黎世联邦理工大学 | 8 |
| 芝加哥大学 | 10 |
| 新加坡国立大学 | 11 |
| 宾夕法尼亚大学 | 13 |
| 洛桑联邦理工学院 | 14 |
网络优惠
预约试听
A-Level
雅思
留学咨询
留学规划