
在众多A-Level热门科目中,A-Level化学是不少专业选择的必修科目,A-Level化学涉及各种元素和化学反应方程式等,需要大家在平时加强记忆。下面,跟随锦秋魏宜奇来看一下Hess’s Law在计算题中的应用。
一个概念叫“焓”(Enthalpy),它指的是一份物质所具有的能量,用焓=内能+压强*体积来表示。然而对于焓的理解是比较抽象的,但理解焓的差值“焓变”就容易多了。
很多化学反应,在反应前后会有温度变化,例如木炭燃烧、硝酸铵结冰等。这就代表了吸热或放热反应中的能量得失。这部分能量我们就称之为“焓变”。例如我们在室外燃烧一小块炭生成CO2放出10kJ热量,那么这部分能量就用∆H来表示,代表燃烧过程中逸散到空气中的热量。反应产生的能量变化可以是不同形式的,包括热量、光、体积变化等等,但这些能量的变化,我们都可以称之为“焓变”。
焓变也有不同的形式,例如反应焓、形成焓、燃烧焓、中和焓和原子化焓等,这些焓有些是可以实际测量的,也有些是我们为了计算而虚构的,实际反应可能并不存在。
那么,在引入了焓的概念以及各类焓的定义之后,就来看看他在我们的题目里是怎么应用的吧。在此之前,我们需要理解Hess’s Law是如何运用的。

对于一个化学反应,总能量变化是一定的,无论经过几步反应,或者经过什么反应路径,甚至是虚构的中间步骤。类似于物理或者数学中的向量,无论你经过几个(连续的)步骤,只要起点和终点是相同的,向量和也就相同。
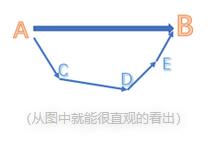
下面我们做一道题来尝试一下吧!(题目如下)

在此题中,我们无法直接求得由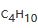 的燃烧焓,那么我们就需要走一个弯路,寻求反应物和生成物之间的一个共同终点站 B,也就是C、
的燃烧焓,那么我们就需要走一个弯路,寻求反应物和生成物之间的一个共同终点站 B,也就是C、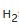 和氧气分别形成它们的形成焓
和氧气分别形成它们的形成焓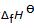 。尽管并不可能用碳粉和氢气氧气来制成丁烷,但在原子数上,ABC 确实都保持了平衡,那么这个循环就是成立的。我们来画出一个焓变示意图。
。尽管并不可能用碳粉和氢气氧气来制成丁烷,但在原子数上,ABC 确实都保持了平衡,那么这个循环就是成立的。我们来画出一个焓变示意图。
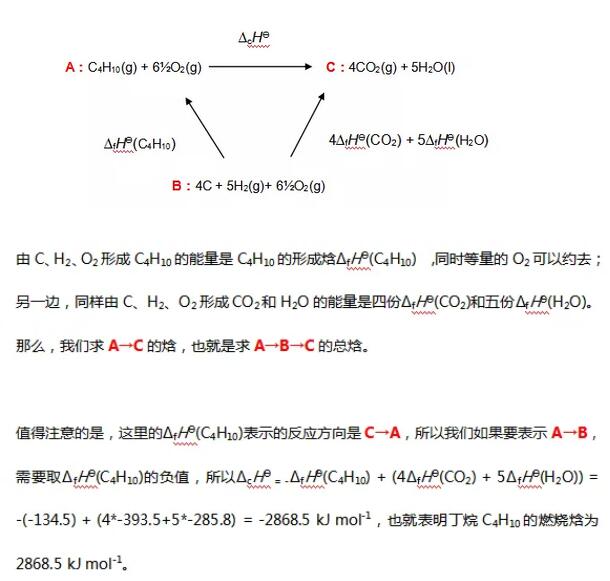
这道题算是一种简单的循环,更复杂的循环会涉及到多步反应和相变,在同学们刷题过程中,如果遇到也不要害怕。注意反应方向和保持元素平衡,即使是十几步反应,也能像拼图一样一步步完整起来。
如果大家还想了解更多有关A-Level科目及考试等方面的信息,可以在线咨询或者扫码关注我们!锦秋A-Level紧抓中国学生理科优势,进行课程组合化。开设数学、物理、化学、生物、经济学、会计学等课程,帮助学生以优异成绩申请更好的大学。

| 大学名称 | QS排名 |
|---|---|
| 麻省理工学院 | 1 |
| 剑桥大学 | 3 |
| 斯坦福大学 | 3 |
| 牛津大学 | 2 |
| 哈佛大学 | 5 |
| 加州理工学院 | 6 |
| 帝国理工学院 | 7 |
| 伦敦大学学院 | 8 |
| 苏黎世联邦理工大学 | 8 |
| 芝加哥大学 | 10 |
| 新加坡国立大学 | 11 |
| 宾夕法尼亚大学 | 13 |
| 洛桑联邦理工学院 | 14 |
网络优惠
预约试听
A-Level
雅思
留学咨询
留学规划